O produto tem um ‘chip’ que detecta no sangue de pacientes a presença de certos trechos de DNA, que podem ser alterações genéticas associadas a problemas de saúde ou sequências do material genético de microrganismos patogênicos. (foto: QuantuMDx)
Uma gota de sangue e 10 minutos de espera é o que vai bastar para você saber se tem alguma alteração genética associada a uma doença grave ou se está infectado com algum parasita. Essa é a promessa de um dispositivo portátil e descartável desenvolvido por cientistas da Austrália e dos Estados Unidos que será lançado já no ano que vem para detectar malária.
O produto inovador é uma espécie de cartão, do tamanho de um celular, que usa um chip para detectar trechos específicos de DNA em uma gota de sangue.
No caso da malária, o chip é preparado com trechos de metade da fita de DNA do parasita causador da doença, o Plasmodium, e reagentes que dividem o DNA do sangue testado. Se a gota de sangue estiver contaminada com o microrganismo, o DNAdo invasor se une aos trechos do chip. O resultado desse processo é verificado por uma máquina na qual o dispositivo é inserido para que seja fornecido o diagnóstico final.
Para o teste de alterações genéticas, o procedimento é o mesmo. O chip é preparado com trechos de DNA que contenham as mutações procuradas. Cada dispositivo podeser desenhado para fazer até 1.500 testes.
O geneticista John Burn, professor da Universidade de Newcastle (Reino Unido) e diretor da empresa que vai fabricar o produto, a QuantuMDx, acredita que a invenção vai mudar totalmente o modo como os testes genéticos são feitos hoje.
“A nossa tecnologia vai tornar o genoma completo dispensável, pois desenhamos perguntas específicas para problemas específicos”, disse em entrevista durante o 6º Fórum Mundial de Ciência, que acontece esta semana no Rio de Janeiro. “Não será mais preciso esperar semanas para ter o sequenciamento completo do seu DNA se você poderá simplesmente fazer o teste para procurar pelas alterações e doenças que lhe interessam.”
O teste convencional de genoma, que analisa todos os genes ativos em busca de mutações associadas a doenças, está cada vez mais popular. Se, em 2000, custava até 100 milhões de dólares, hoje é feito em laboratórios estrangeiros por cerca de mil dólares. Mas o novo dispositivo, além de mais rápido, pode ser ainda mais barato.
Segundo Burn, cada dispositivo descartável desenhado para um único teste vai custar em torno de 20 dólares se comprado em pequenas quantidades e cinco dólares se produzido em larga escala por algum fabricante médico interessado.
Além do teste para malária, já está sendo desenvolvido um teste para detectar alterações no gene BRAF, ligado ao câncer de pele, e outro para detectar marcadores genéticos associados à resistência ao medicamento varfarina, anticoagulante usado no tratamento de trombose que pode ocasionar sangramentos como efeito colateral.
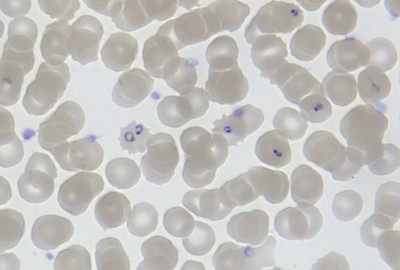
Em 2014, o dispositivo estará disponível para detectar o material genético do parasita causador da malária, o ‘Plasmodium’, no sangue do paciente. (foto: MichaelZahniser/ Wikimedia Commons)
Burn avisa que o dispositivo pode ser desenhado para detectar qualquer alteração genética associada a qualquer doença conhecida.
Nas mãos do paciente
A ideia do geneticista é que o dispositivo seja vendido para hospitais, clínicas, consultórios e também para pessoas individualmente. Segundo ele, os testes poderiam ser manuseados pelo próprio paciente e encaminhados para uma central que dispusesse da máquina leitora que provê o resultado.
O teste pode ser feito por qualquer um, sem a necessidade de um treinamento médico”, disse. “Isso vai facilitar o diagnóstico em nações mais pobres e sem sistemas desaúde estruturados, como, por exemplo, os países da África que sofrem com a malária, e até o interior do Brasil”. E continuou: “Além disso, vai dar mais privacidade ao paciente. Meninas jovens que quiserem fazer um testepara uma doença sexualmente transmissível, como a clamídia, e tiverem vergonha de dividir a suspeita com um médico vão poder aplicar o teste em si mesmas e depois só pegar o resultado.”
O cenário descrito por Burn pode parecer bom, entretanto não é aceito por todos. O físico e especialista em política científica húngaro József Pálinkás, que preside o Fórum Mundial de Ciência, defende que testes genéticos devem ser feitos com a assistênciade um médico ou geneticista.
“Acredito que esse não é o melhor modo de desenvolver testes”, disse. “As pessoas pegam todo tipo de informações e nem sempre sabem usá-las apropriadamente. Ainda precisamos da expertise médica para nos direcionar.”
Sofia Moutinho
Ciência Hoje On-line